慢病毒包装(Lentivirus Package)
参照FDA、《中国药典》病毒疫苗制剂的标准,开发了以超滤,超速离心,切向流,阴阳离子交换层析,凝胶层析等纯化方法为基础的慢病毒纯化工艺,生产满足您从永生化细胞,原代和干细胞,动物体内水平以及cGMP细胞治疗水平等不同实验所需要的病毒产品。注释:FDA和《中国药典》中针对病毒疫苗等制剂的要求主要从病毒滴度(≥2E+8 TU/ml),质粒残留(≤4E+8 copy/ml),宿主DNA残留(≤ 10ng/ml),BSA残留(≤ 50ng/ml)等方面针对产品质量和安全性提出纯度要求,同时针对污染和载体安全性,提出了支原体,细菌等微生物安全和RCL的要求。@
先进可靠的工艺ADVANCED AND RELIABLE TECHNOLOGY
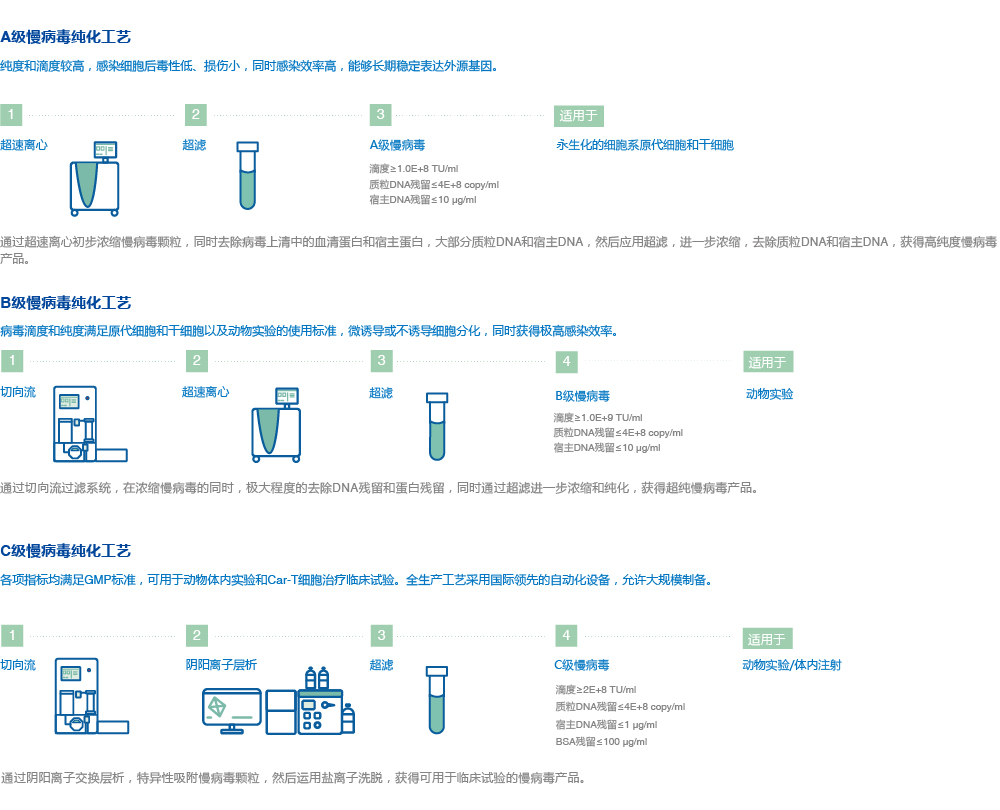
A级慢病毒纯化工艺——纯度和滴度较高,感染细胞后毒性低、损伤小,同时感染效率高,能够长期稳定表达外源基因。
*滴度≥1.0E+8 TU/ml,质粒DNA残留≤4E+8 copy/ml,宿主DNA残留小于等于10 μg/ml
B级慢病毒纯化工艺———病毒滴度和纯度满足原代细胞和干细胞以及动物实验的使用标准,微诱导或不诱导细胞分化,同时获得极高感染效率。
*滴度≥1.0E+9 TU/ml,质粒DNA残留≤4E+8 copy/ml,宿主DNA残留小于等于10 μg/ml
C级慢病毒纯化工艺———各项指标均满足GMP标准,可用于动物体内实验和Car-T细胞治疗。全生产工艺采用国际领先的自动化设备,允许大规模制备。
*滴度≥2E+8 TU/ml,质粒DNA残留≤4E+8 copy/ml,宿主DNA残留小于等于1 μg/ml,BSA残留≤100 μg/ml
注释:FDA和《中国药典》中针对病毒疫苗等制剂的要求主要从病毒滴度(≥2E+8 TU/ml),质粒残留(≤4E+8 copy/ml),宿主DNA残留(≤ 10ng/ml),BSA残留(≤ 50ng/ml)等方面针对产品质量和安全性提出纯度要求,同时针对污染和载体安全性,提出了支原体,细菌等微生物安全和RCL的要求。
工艺流程THE PROCESS FLOW